Химические процессы в свинцово-кислотных аккумуляторах
- 29-10-2013, 01:40
- Просмотров: 25071
- Комментариев: 0
- Информация
 Химические процессы в свинцово-кислотных аккумуляторах
Химические процессы в свинцово-кислотных аккумуляторахКак не формулируй название статьи, - оно всё равно будет правильным. Химия и энергия - связаны воедино в конструкции аккумулятора.
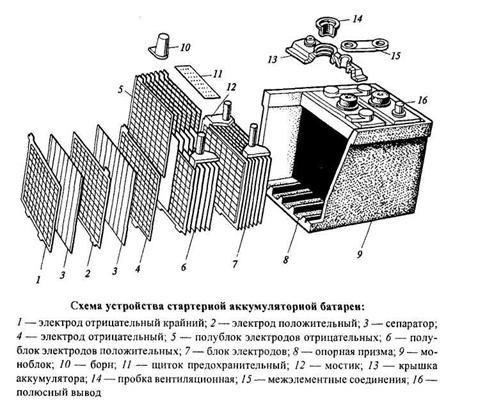
Свинцово-кислотные аккумуляторы могут работать несколько лет в режимах заряда-разряда. Они быстро подзаряжаются и быстро отдают запасённую энергию. Секрет этих метаморфоз кроется в химии, ведь именно она помогает преобразовывать электричество, но как?
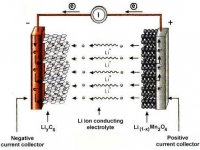
 «Таинство» преобразования энергии в аккумуляторе обеспечивает совокупность реагентов, среди которых есть окислитель и восстановитель, взаимодействующие через электролит. Восстановитель (губчатый свинец РЬ) имеет отрицательный заряд. Во время химической реакции он окисляется, и его электроны странствуют к окислителю, у которого положительный заряд. Окислитель (диоксид свинца РЬО2) восстанавливается, а результатом этого является электрический ток.
«Таинство» преобразования энергии в аккумуляторе обеспечивает совокупность реагентов, среди которых есть окислитель и восстановитель, взаимодействующие через электролит. Восстановитель (губчатый свинец РЬ) имеет отрицательный заряд. Во время химической реакции он окисляется, и его электроны странствуют к окислителю, у которого положительный заряд. Окислитель (диоксид свинца РЬО2) восстанавливается, а результатом этого является электрический ток. В качестве электролита используют жидкость, которая плохо проводит ток, но является хорошим проводником для ионов. Это водный раствор серной кислоты (H2S04). В химической реакции происходит процесс, всем известный со школьной скамьи - электролитическая диссоциация.
В процессе реакции, - положительно заряженные ионы (Н+) направляются к положительному электроду, а отрицательно заряженные ионы (SO42-) к отрицательному. Когда аккумулятор разряжается, то из восстановителя (губчатый свинец), через электролит к положительному электроду, - направляются ионы с положительным зарядом РЬ2+.
Четырехвалентные ионы свинца (РЬ4+) превращаются в двухвалентные (РЬ4+). Однако, это еще не все химические реакции. Когда ионы кислотных остатков с отрицательным зарядом (SO42-) соединяются с положительно заряженными ионами свинца (РЬ2+), то на обоих электродах образуется сульфат свинца (РЬSО4). А вот это уже плохо для аккумулятора. Сульфатация сокращает срок службы аккумулятора и постепенно накапливаясь, может привести к его разрушению. Побочным эффектом химических реакций в обычных свинцово-кислотных аккумуляторах, являются газы.
Что же происходят, когда аккумулятор подзаряжают?
Электроны направляются к электроду с отрицательным зарядом, где выполняют свою функцию - нейтрализуют ионы свинца (РЬ2+). Химические реакции, происходящие в аккумуляторных батареях можно описать такой формулой:
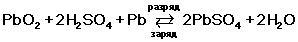
Плотность электролита, и его уровень в аккумуляторе, зависит от того, - заряжен, или разряжен аккумулятор. Изменения плотности электролита можно описать следующей формулой:
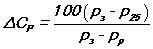
где показатель разрядки аккумулятора, который измеряется в процентах, - Cp. Плотность электролита при полной зарядке - Рз. Плотность электролита при полной разрядке - Pр.
Стандартная температура, при которой делают измерения + 25°С, Плотность электролита в соответствии с температурой + 25°С, г/см3 - Р25.
Во время химической реакции положительные электроды используют в 1,6 раза больше кислоты, чем отрицательные. Когда аккумулятор разряжается, то объем электролита растет, а когда заряжается, наоборот - уменьшается.
Таким вот образом, с помощью химических реакций, аккумулятор принимает, а потом отдаёт электрическую энергию.
Внимание!
Уважаемый посетитель, Вы зашли на сайт как незарегистрированный пользователь.
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.
Мы рекомендуем Вам зарегистрироваться либо войти на сайт под своим именем.
